Immunity|T细胞「集体自杀」真相曝光!郑大一附院张毅团队破解肿瘤微环境「死亡代码」PLPP1
英文标题:PD-1 signaling limits expression of phospholipid phosphatase 1 and promotes intratumoral CD8+T cell ferroptosis
中文标题:PD-1信号传导限制磷脂磷酸酶1的表达并促进肿瘤内CD8+T细胞铁死亡
发表期刊:Immunity
影响因子:25.5
客户单位:郑州大学第一附属医院
百趣提供服务:经典脂质组学、定量脂质组学、游离脂肪酸
研究背景
新陈代谢在机体对癌症的免疫反应中占据着至关重要的地位。肿瘤内葡萄糖、脂质和氨基酸代谢的改变,会对免疫细胞的抗肿瘤活性产生显著影响,进而推动肿瘤的发展进程。其中,脂质代谢不仅在调节细胞信号转导方面发挥着关键作用,还为细胞活动提供必要的能量支持,而脂质代谢过程中产生的脂质介质,能够从多个维度对免疫反应进行调控。肿瘤微环境(Tumor Microenvironment, TME)是一个极为复杂且代谢紊乱的环境。在这样的环境中,CD8+T细胞的脂质代谢出现异常。这种异常进一步加剧了CD8+T细胞的耗竭,使其在增殖能力和免疫功能方面表现不佳。磷脂作为众多细胞类型中含量最为丰富的代谢产物之一,在免疫反应中扮演着不可或缺的角色。它参与了多种免疫细胞功能的调节,对维持正常的免疫应答具有重要意义。
研究结果
1、瘤内CD8+T细胞中Plpp1的表达减少与抗肿瘤功能降低相关
研究者收集了5例肺癌患者的外周血单核细胞(Peripheral Blood Mononuclear Cells, PBMCs)和肿瘤组织样本。相较循环活化CD8+(CD69+CD8+)T细胞,瘤内CD8+T细胞的脂质代谢发生改变:甘油磷脂占比最高(76%,图1A),包括磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰甘油(PG)、磷脂酰肌醇(PI)、磷脂酰丝氨酸(PS)和心磷脂(CL),其中PC和PE差异最大(图1B),表达减少(图1C)。PC和PE的合成主要由PLPP1催化,瘤内CD8+T细胞中的异常磷脂代谢可能受PLPP1控制(图1D)。在肺癌患者中,瘤内CD8+T细胞中的PLPP1 mRNA和PLPP1蛋白水平较循环CD8+T细胞的低(图1E-G)。相较于PLPP1hiCD8+T细胞,PLPP1loCD8+T细胞内干扰素(IFN)-γ和肿瘤坏死因子α(TNF-α)的表达量低(图1H)。
基于GEO数据库中36例初治早期肺癌患者肿瘤组织的CD8+T细胞RNA测序的GSEA结果表明,PLPP1hiCD8+T细胞具有烟酰胺腺嘌呤二核苷酸磷酸(NADPH)再生,活性氧(ROS)代谢负调控的特征(图1I)。KEGG通路分析显示,PLPP1hi组DNA复制、细胞分裂和细胞周期的转录特征增强(图1J)。PLPP1表达与T细胞活化和细胞毒性特征基因的表达呈正相关,而与IFNGR1的表达呈负相关(图1K),后者同T细胞活化诱导的细胞凋亡相关。结果表明,PLPP1介导的瘤内CD8+T细胞磷脂代谢受损,从而触发CD8+T细胞功能障碍。
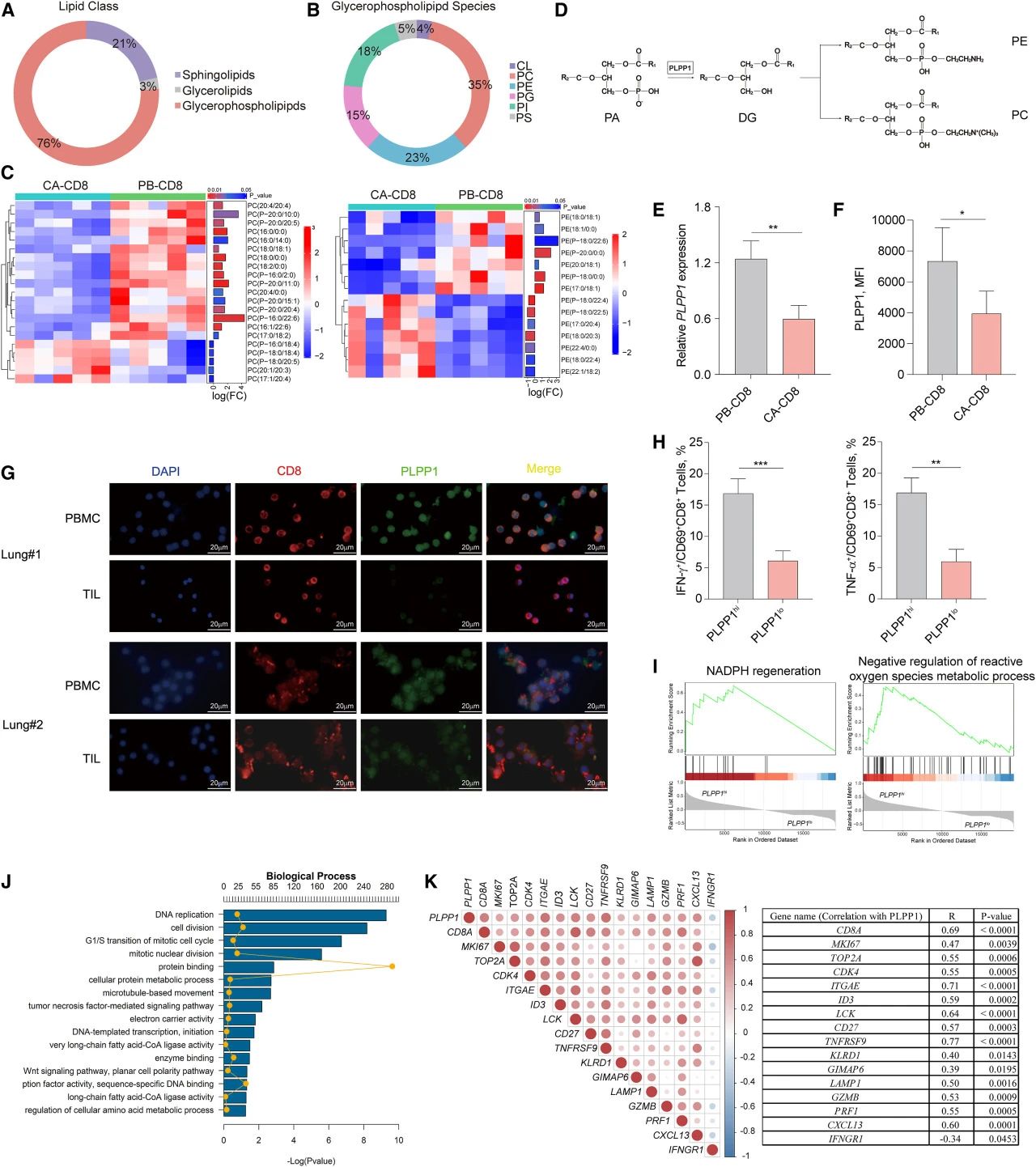
图1.瘤内CD8+T细胞中参与磷脂代谢和功能的PLPP1表达低
2、Plpp1缺陷通过铁死亡降低瘤内CD8+T细胞的细胞毒性功能
研究者进一步探究了Plpp1是否调控CD8+T细胞的行为。与Plpp1fl/fl小鼠相比,仅在T细胞区缺乏Plpp1的Lckcre-Plpp1fl/fl小鼠表现出更快的B16黑色素瘤生长速率(图2A)和更短的生存时间(图2B)。而当CD8+T细胞被耗竭时,二者的肿瘤生长和存活率相似(图2C-D)。在B16和Lewis肺癌(LLC)中,Lckcre- Plpp1fl/fl小鼠的CD8+T细胞数量较Plpp1fl/fl少(图2E)。将用eFluor 670染色的Lckcre-Plpp1fl/flCD8+OT1 T细胞和用CFSE染色的Plpp1fl/flCD8+OT1 T细胞激活、混合,转移到携带肿瘤的小鼠体内(图2F)。Plpp1缺失导致细胞分裂频率显著降低(图2G)。此外,与Plpp1fl/flCD8+OT1 T细胞相比,瘤内Lckcre-Plpp1fl/flCD8+OT1 T细胞内,抗肿瘤相关基因表达低,共抑制标志物表达高,活化标志物表达低(图2H-I)。这些结果表明,Plpp1的表达有助于CD8+T细胞的细胞毒性功能。
为了阐明潜在机制,研究者分析了B16肿瘤组织内浸润的CD8+T细胞的转录组数据。与Plpp1fl/flCD8+T细胞相比,Lckcre-Plpp1fl/flCD8+T细胞内参与细胞铁死亡及细胞周期调节的基因表达上调,而有利于T细胞活化和存活的基因表达下调(图2J)。GO分析结果表明,Lckcre-Plpp1fl/flCD8+T细胞显示出与氧化应激、氧化磷酸化和脂肪酸代谢相关的基因表达模式增强(图2K)。与Plpp1fl/fl相比,Lckcre-Plpp1fl/flCD8+T细胞内与脂质过氧化或铁死亡激活相关的基因表达更高(图2L)。与氧化应激和铁死亡相关的基因在Lckcre-Plpp1fl/flCD8+T细胞中富集(图2M)。
研究发现,瘤内Lckcre-Plpp1fl/flCD8+T细胞的细胞死亡率高于瘤内Plpp1fl/flCD8+T细胞(图2N)。Lckcre-Plpp1fl/flCD8+T细胞的细胞死亡率仅在铁死亡抑制剂(ferrostatin-1)的作用下降低,而在细胞凋亡抑制剂(Z-VAD-FMK)或坏死性凋亡抑制剂(necrostatin-1)作用下不能(图2O)。Lckcre-Plpp1fl/flCD8+T细胞的功能和增殖也仅能被ferrostatin-1改善(图2P-Q)。为了确定铁死亡对T细胞抗肿瘤功能的影响,研究者使用铁死亡激动剂(FIN56和RSL3)培养Plpp1fl/flCD8+T细胞,发现CD8+T细胞的功能和增殖受到抑制,表明铁死亡抑制了CD8+T细胞的抗肿瘤功能。此外,研究者还用RSL3或ferrostatin-1处理阴性对照(NC)和Plpp1过表达(Plpp1-OE)OT1 CD8+T细胞,并将其注射到携带肿瘤的小鼠体内。体内实验显示,NC CD8+T细胞比Plpp1-OE CD8+T细胞有更高的细胞死亡率和更弱的抗肿瘤功能。在用ferrostatin-1处理后,NC CD8+T细胞实现了同Plpp1-OE CD8+T细胞相似的细胞死亡率和抗肿瘤功能。在用RSL3处理后,Plpp1-OE CD8+T细胞较NC CD8+T细胞表现出更低的细胞死亡率和更高的T细胞功能(图2R-S)。综上,研究强调Plpp1是CD8+T细胞铁死亡的重要调节因子,可影响T细胞抗肿瘤功能。
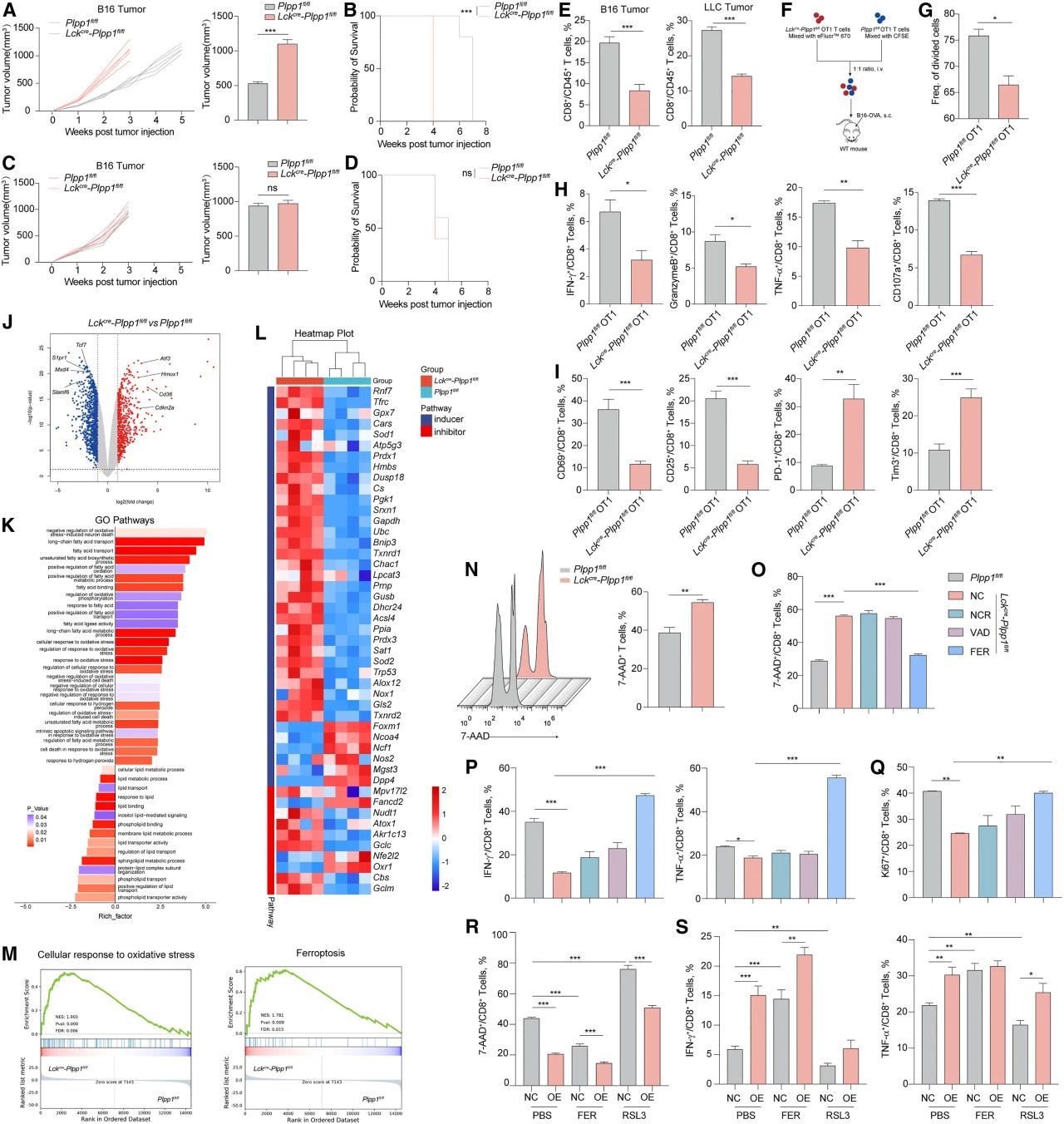
图2.Plpp1缺陷损害CD8+T细胞的存活和抗肿瘤反应
3、脂肪酸诱导Plpp1缺陷型CD8+T细胞的铁死亡
接下来,研究者检测了肿瘤内浸润的Lckcre-Plpp1fl/flCD8+T细胞的铁死亡。B16肿瘤中,Lckcre-Plpp1fl/flCD8+T细胞的ROS水平和脂质过氧化高于Plpp1fl/flCD8+T细胞(图3A-B)。ROS有助于线粒体结构的变化。电子显微镜显示,大多数线粒体中的嵴在Lckcre-Plpp1fl/flCD8+T细胞中是无序的(图3C)。与Plpp1fl/flCD8+T细胞相比,Lckcre-Plpp1fl/flCD8+T细胞中的线粒体面积更小,嵴长度更短(图3D-E)。
与肿瘤组织共培养后,Plpp1fl/fl和Lckcre-Plpp1fl/flCD8+T细胞均表现出更高的ROS水平及更高程度的脂质过氧化(图3F-G)。然而,与前者相比,Lckcre-Plpp1fl/flCD8+T细胞更易于在与肿瘤组织孵育时诱导铁死亡(图3F-G)。脂肪酸是调控T细胞铁死亡的主要物质。B16肿瘤和LLC肿瘤的肿瘤间质液(TIF)内的游离脂肪酸(FFA)含量高于血清或脾脏(图3H)。基于此,FFA在肿瘤组织中积聚,可能诱导铁死亡。此后,研究者检查了脂肪酸对CD8+T细胞铁死亡和抗肿瘤功能的影响。结果发现,用5或10 μM脂肪酸处理的Lckcre-Plpp1fl/flCD8+T细胞比Plpp1fl/flCD8+T细胞有更高的ROS和脂质过氧化水平(图3I-J)。对Plpp1fl/flCD8+T细胞做类似处理后发现,Lckcre-Plpp1fl/flCD8+T细胞的功能更弱(图3K-L)。以上表明,肿瘤部位积累的脂肪酸加剧了Lckcre-Plpp1fl/flCD8+T细胞的铁死亡。
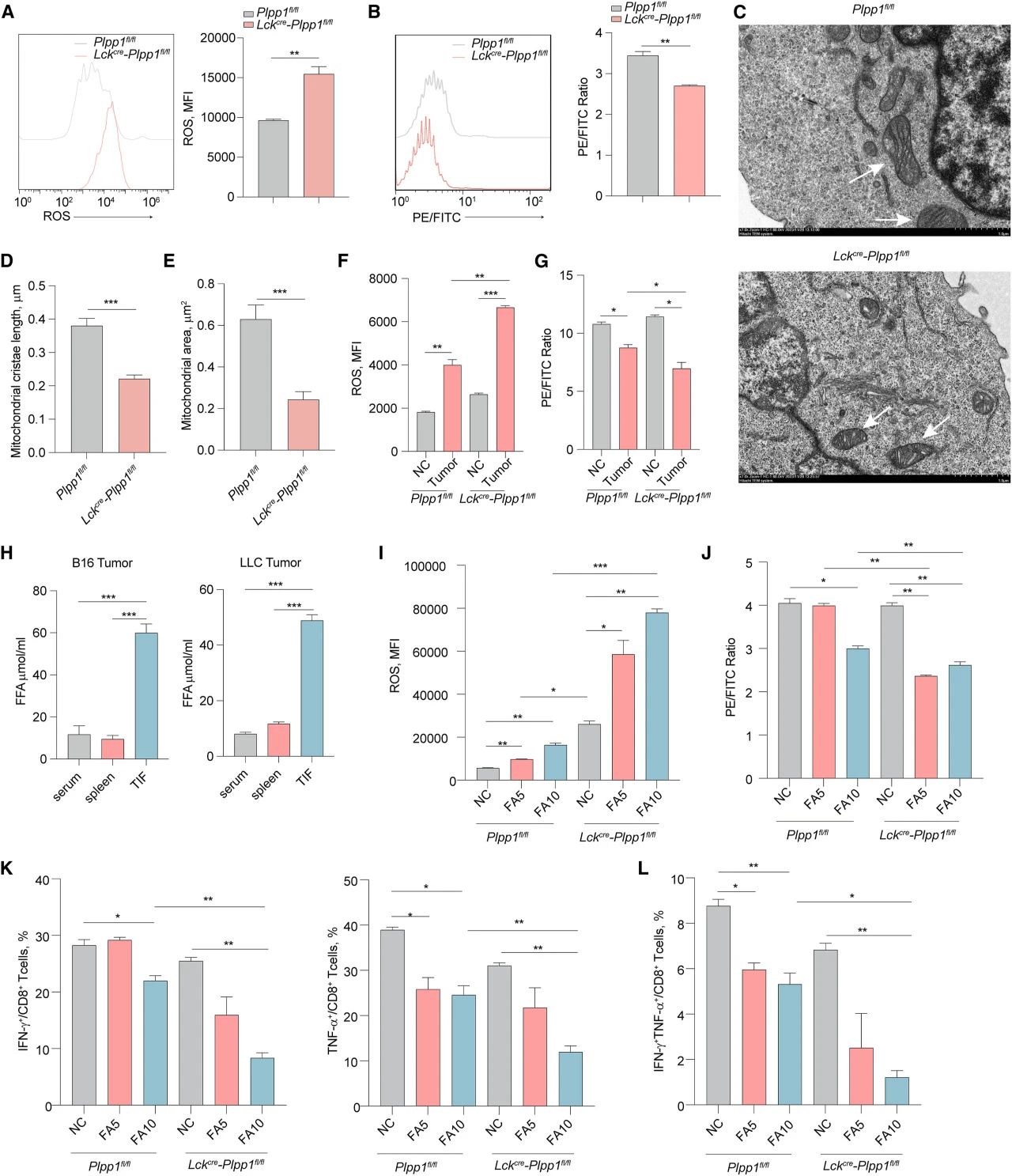
图3.Plpp1缺陷加剧脂肪酸介导的CD8+T细胞铁死亡
4、不饱和脂肪酸促进Plpp1缺陷型CD8+T细胞的铁死亡
研究者推测肿瘤中诱导铁死亡的脂肪酸可能是不饱和脂肪酸。定量代谢组学结果显示,肿瘤中的不饱和脂肪酸含量高于脾脏(图4A),而几种饱和脂肪酸的含量较脾脏低(图4B)。
花生四烯酸(AA)和十八碳烯酸(OA)可诱导铁死亡。用AA或OA处理后,Lckcre-Plpp1fl/flCD8+T细胞中含有AA或OA的PC和PE的差异倍数高于Plpp1fl/flCD8+T细胞内的(图4C-D)。在Lckcre-Plpp1fl/flCD8+T细胞中,AA和OA通过这些通路使铁死亡增加,T细胞受体信号通路、糖酵解和丙酮酸代谢减少(图4E-F)。数据表明,不饱和脂肪酸改变磷脂种类以诱导Plpp1缺陷型CD8+T细胞发生铁死亡。
研究者发现AA促进了T细胞死亡,Lckcre-Plpp1fl/flCD8+T细胞死亡率高于Plpp1fl/flCD8+T细胞。Ferrostatin-1能降低AA处理后的Lckcre-Plpp1fl/flCD8+T细胞的死亡率(图4G)。AA诱导的ROS水平和脂质过氧化在Lckcre-Plpp1fl/flCD8+T细胞中较Plpp1fl/flCD8+T细胞中高(图4H-I)。此外,研究者发现用Plpp1激动剂处理体外激活的CD8+T细胞后,AA诱导细胞死亡率、ROS和脂质过氧化的作用被抵消(图4J-L)。最后,构建了间皮素(MSLN) 靶向嵌合抗原受体T(CAR-T)细胞和PLPP1过表达MSLN(MSLN-PLPP1)CAR-T细胞(图4M)。PLPP1过表达可增加CAR-T细胞中磷脂的水平(图4N-O),能更有效地抑制肿瘤生长(图4P),MSLN-PLPP1 CAR-T细胞的功能和增殖也得到了增强(图4Q-R)。总的来说,这些结果突出表明PLPP1是维持CD8+T细胞存活和正常功能所必需的。
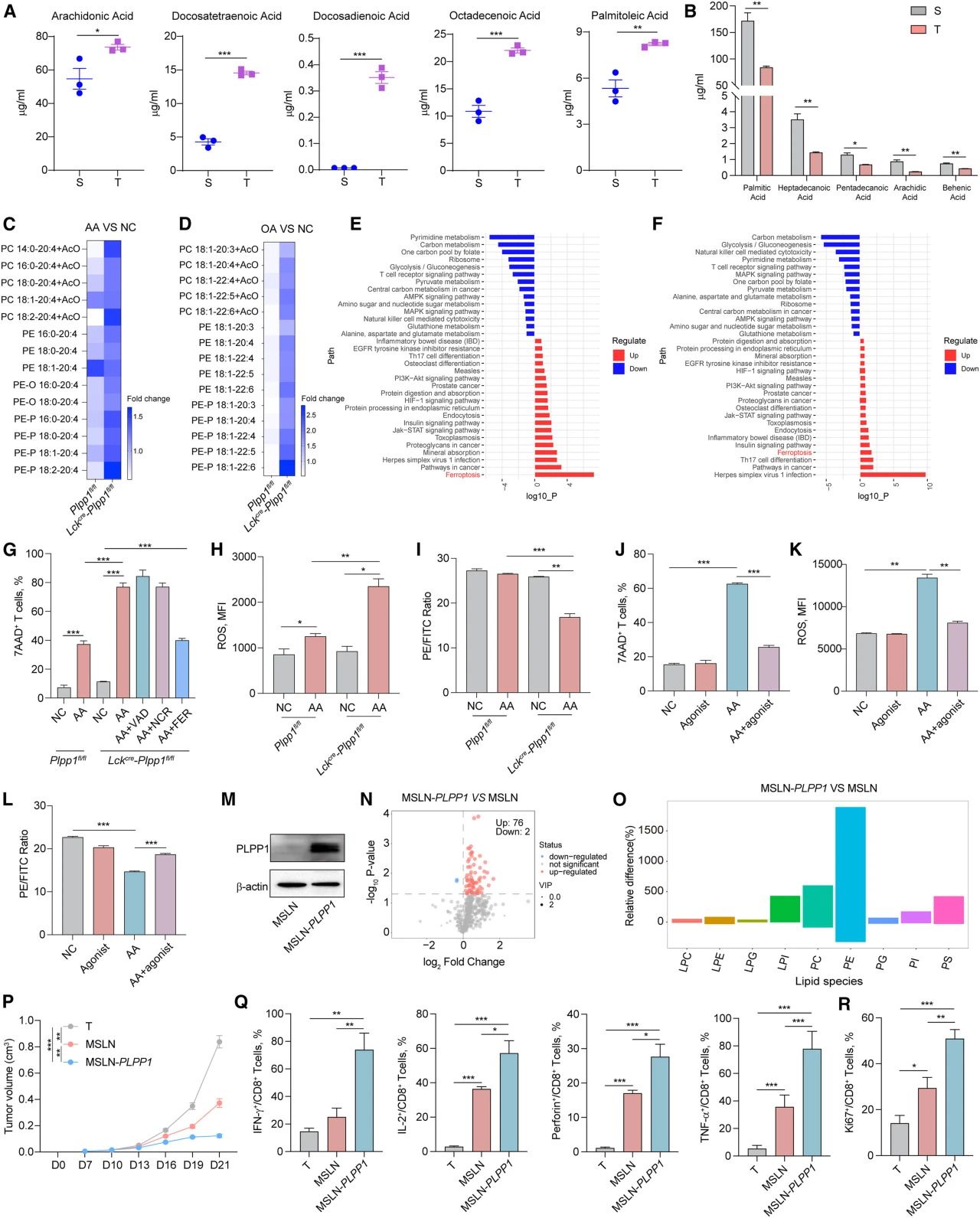
图4.肿瘤中积聚的不饱和脂肪酸诱导Plpp1缺陷型CD8+T细胞铁死亡
5、PD-1信号抑制瘤内CD8+T细胞中Plpp1的表达
瘤内CD8+T细胞中的Plpp1表达下降,表现出铁死亡的特征。为了探索潜在的机制,研究者将CD8+T细胞与肺癌细胞共培养,发现CD8+T细胞中的PLPP1 mRNA表达下降(图5A)。将小鼠CD8+OT1 T细胞同黑色素瘤细胞B16过表达卵清蛋白(B16-OVA)共孵育,获得了类似的结果(图5B)。PD-1和细胞毒性T淋巴细胞相关蛋白4(CTLA4)是主要的T细胞功能抑制因子。观察到当使用PD-1阻断抗体而不是CTLA4阻断抗体时,CD8+T细胞中PLPP1蛋白量的下调更少(图5C),因此推测PD-1信号可能调节PLPP1表达。
为了验证假设,重新分析了活化的人源CD8+T细胞(TACT)和TACT与PD-1信号激活剂程序性死亡配体1(PD-L1)Fc(TACT+PD-L1)共培养的RNA-seq数据集。同TACT组相比,TACT+PD-L1组PLPP1 mRNA表达减少(图5D)。成像流式细胞术证实,PD-L1 Fc诱导的PD-1信号激活下调了活化的CD8+T细胞中的PLPP1和IFN-γ水平(图5E)。此外,通过用IFN-γ培养MC38肿瘤细胞以增加PDL1的表达,然后固定PDL1并用于刺激PD-1信号通路。在与固定MC38肿瘤细胞共培养的CD8+T细胞中,脂质过氧化、ROS产生和细胞死亡率均增加,而它们都被PD-1阻断剂削弱(图5F-H)。这些结果表明,PD-1信号激活诱发T细胞铁死亡。
接下来,研究者将活化的OT1 T细胞经静脉过继性转移到携带B16-OVA肿瘤的小鼠体内(图5I)。与对照小鼠相比,抗PD-1治疗减缓了肿瘤生长(图5J),减少了肺中肿瘤结节的数量(图5K)。抗PD-1治疗增加了肿瘤组织中表达Plpp1、Ki67和IFN-γ的CD8+T细胞的占比(图5L-N)。此外,在抗PD-1治疗后,瘤内CD8+T细胞的细胞死亡率和脂质过氧化降低(图5O-P)。综上,这些发现表明PD-1信号的激活抑制了Plpp1表达,以致CD8+T细胞铁死亡。
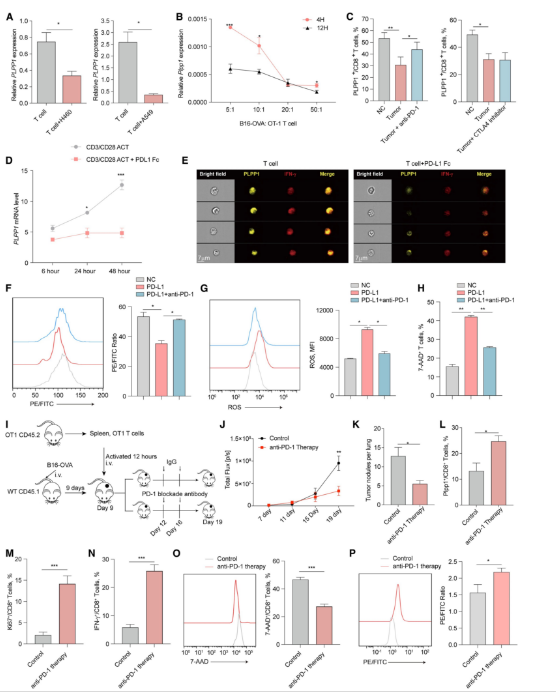
图5.PD-1信号转导限制CD8+T细胞中Plpp1的表达,损害抗肿瘤免疫
6、GATA1受PD-1信号调节并限制PLPP1表达
PD-1介导的Akt通路参与调节T细胞的增殖和功能。研究者发现PLPP1hiCD8+T细胞表现出增强的磷脂酰肌醇3-激酶(PI3K)-Akt机制/哺乳动物雷帕霉素靶 (mTOR) 通路活性(图6A)。假设PD-1介导的Akt通路可能抑制PLPP1。磷酸化Akt(p-AKT)被PD-L1 Fc抑制(图6B)。用抗PD-1抗体处理后,TME中过继转移的CD8+OT1 T细胞中p-AKT占比增加(图6C),而Plpp1不影响p-AKT的百分比(图6D)。此外,使用激活的人源CD8+T细胞(有或没有PD-L1 Fc处理),创建RT2 profiler PCR阵列,监测能够控PLPP1表达的转录因子,最终鉴定出了14个转录因子(图6E)。使用PROMO网站确定了76个与PLPP1启动子区域结合的潜在转录因子。最后,综合以上结果,确定了五个转录因子(GATA1、E2F1、HNF1A、HNF4A、ARNT)。染色质免疫沉淀定量PCR (ChIP-qPCR)显示GATA1在PLPP1位点显著富集(图6F)。与对照组相比,Akt抑制剂处理组的GATA1结合富集增加(图6G)。PD-L1 Fc处理增加了GATA1的核转位,而加用PD-1阻断抗体处理后,该现象明显减少(图6H)。正如预期,Akt抑制剂抑制了小鼠活化CD8+T细胞中Plpp1蛋白表达,促进了GATA1的表达,并下调了白细胞介素(IL)-2和Ki67的表达(图6I-K)。在Akt抑制剂处理的CD8+T细胞中,GATA1的核转位增加(图6L)。
此外,为了评估GATA1对PLPP1表达和抗肿瘤功能的影响,构建了GATA1sh OT1 T细胞和T细胞过继转移肿瘤模型(图6M)。结果显示,GATA1sh组PD-1+CD8+T细胞中Plpp1蛋白量较NC组更高(图6N)。与NC组相比,GATA1sh中OT1 T细胞浸润和抗肿瘤功能更强(图6O-P)。以上表明,PD-1信号通过Akt-GATA1通路抑制Plpp1表达,导致CD8+T细胞功能障碍。
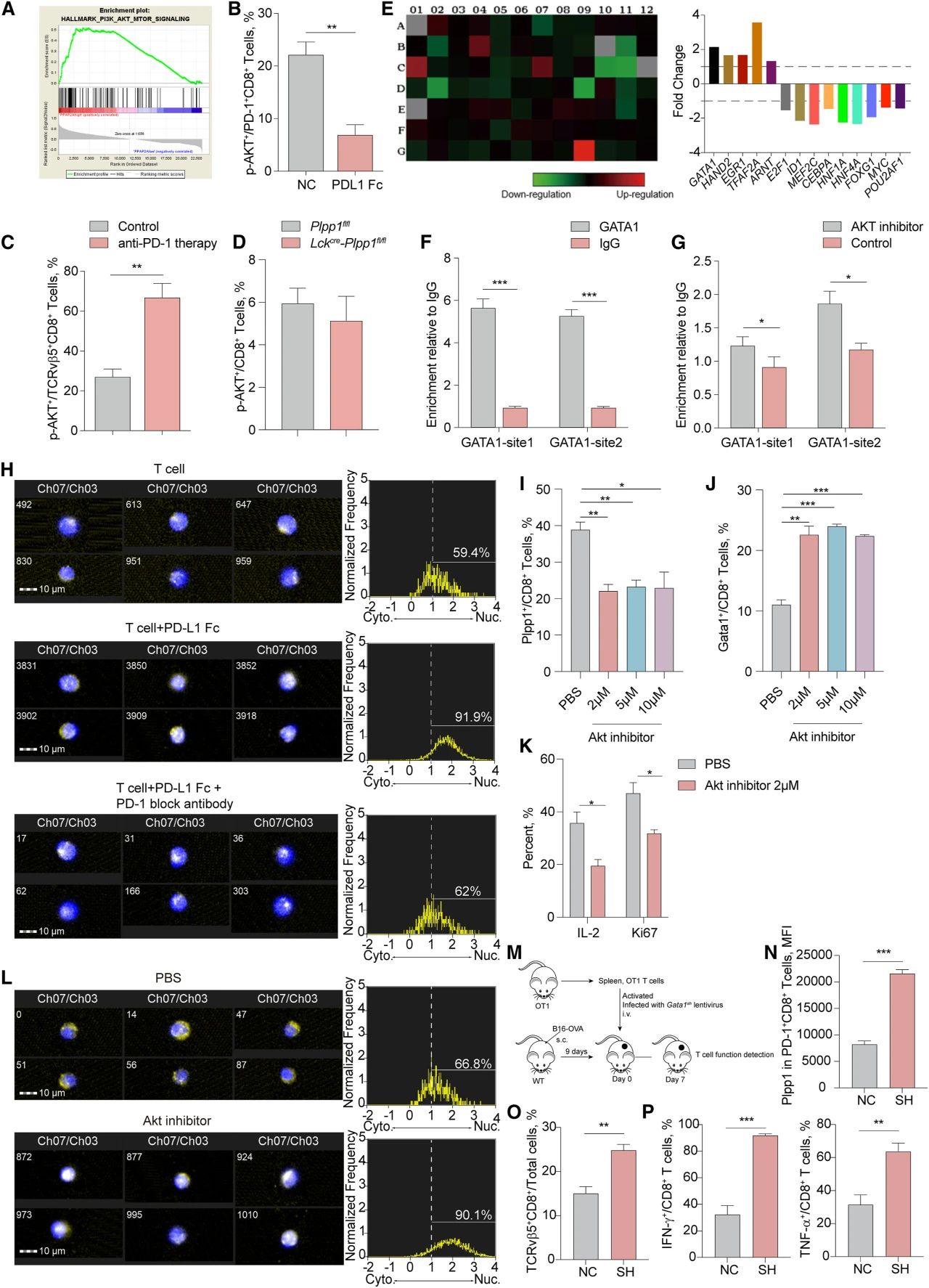
图6.PD-1诱导的GATA1与PLPP1启动子结合以改变PLPP1表达
7、Plpp1缺陷减弱了体内抗PD-1治疗的反应
研究者用Plpp1fl/fl或Lckcre-Plpp1fl/flOT1 CD8+T细胞及PD-1阻断抗体或免疫球蛋白G(IgG)治疗B16-OVA肿瘤携带小鼠(图7A)。接受过继转移Plpp1fl/flOT1 CD8+T细胞,用PD-1阻断抗体处理的小鼠肿瘤比用IgG处理的长得慢;然而,接受过继转移Lckcre-Plpp1fl/flOT1 CD8+T细胞,用IgG处理的小鼠与用PD-1阻断抗体处理的小鼠,肿瘤生长曲线类似(图7B)。TME中,PD-1阻断剂增加了Plpp1fl/flOT1 CD8+T细胞的频率,而Lckcre-Plpp1fl/flOT1 CD8+T细胞占比没有增加(图7C)。此外,PD-1阻断增加了表达IFN-γ的Plpp1fl/flOT1 CD8+T细胞的百分比,但不增加Lckcre-Plpp1fl/flOT1 CD8+T细胞的,表达IFN-γ的Lckcre-Plpp1fl/flOT1 CD8+T细胞占比较Plpp1fl/flOT1 CD8+T细胞低(图7D)。
研究者从接受PD-1阻断抗体治疗的B16肿瘤中分离出浸润的CD8+T细胞,并进行了scRNA-seq测序。Plpp1fl/fl和Lckcre-Plpp1fl/flOT1 CD8+T细胞表现出8个不同的簇(图7E)。Lckcre-Plpp1fl/flOT1 CD8+T细胞主要集中在簇1、2和3,而簇0、4、5、6在Plpp1fl/flCD8+T细胞中富集(图7F)。基于T细胞亚型(幼稚/记忆、效应和耗竭)的标志物,聚类3被鉴定为幼稚簇,而聚类1表现出耗竭亚型。与铁死亡相关的标志物在第2簇中增加。簇0和6中有丝分裂相关基因的表达相对较高。簇4、5和7被鉴定为效应亚型(图7G)。超氧化物合成的NADPH氧化酶激活剂活性、氧化应激应对、细胞死亡调节和细胞脂质代谢过程在簇2中富集,表明抗PD-1治疗并没有减少Lckcre-Plpp1fl/flOT1 CD8+T细胞的铁死亡(图7H)。簇1中细胞死亡途径的负性调控降低。在第3簇中,繁殖和激活的相关途径减少,包括钙依赖性磷脂结合、氧化磷酸化和磷脂代谢过程(图7H)。
此外,研究者整合并分析了来自不同类型人类肿瘤的单细胞RNA测序数据。PD-1+CD8+T细胞的分析产生了10个簇(图7I)。簇3可能是一个高度增殖的亚群,其内PLPP1高表达(图7J)。使用来自GEO:GSE90730的转录组数据,可见PLPP1表达与抗PD-1治疗的响应基因增加呈正相关(图7K)。在36名食管癌患者(图7L)和58名晚期肺癌患者(图7M)中,CD8+T细胞中的PLPP1表达与Ki67表达高度相关。CD8+T细胞中的PLPP1表达与T细胞细胞毒性细胞因子相关(图7N)。在17名食管癌患者和35名晚期肺癌患者中,抗PD-1治疗促进了PLPP1的表达(图7O)。这些结果强调PLPP1赋予CD8+T细胞增殖和细胞毒性的能力,而这可以通过抗PD-1得到治疗性的恢复。
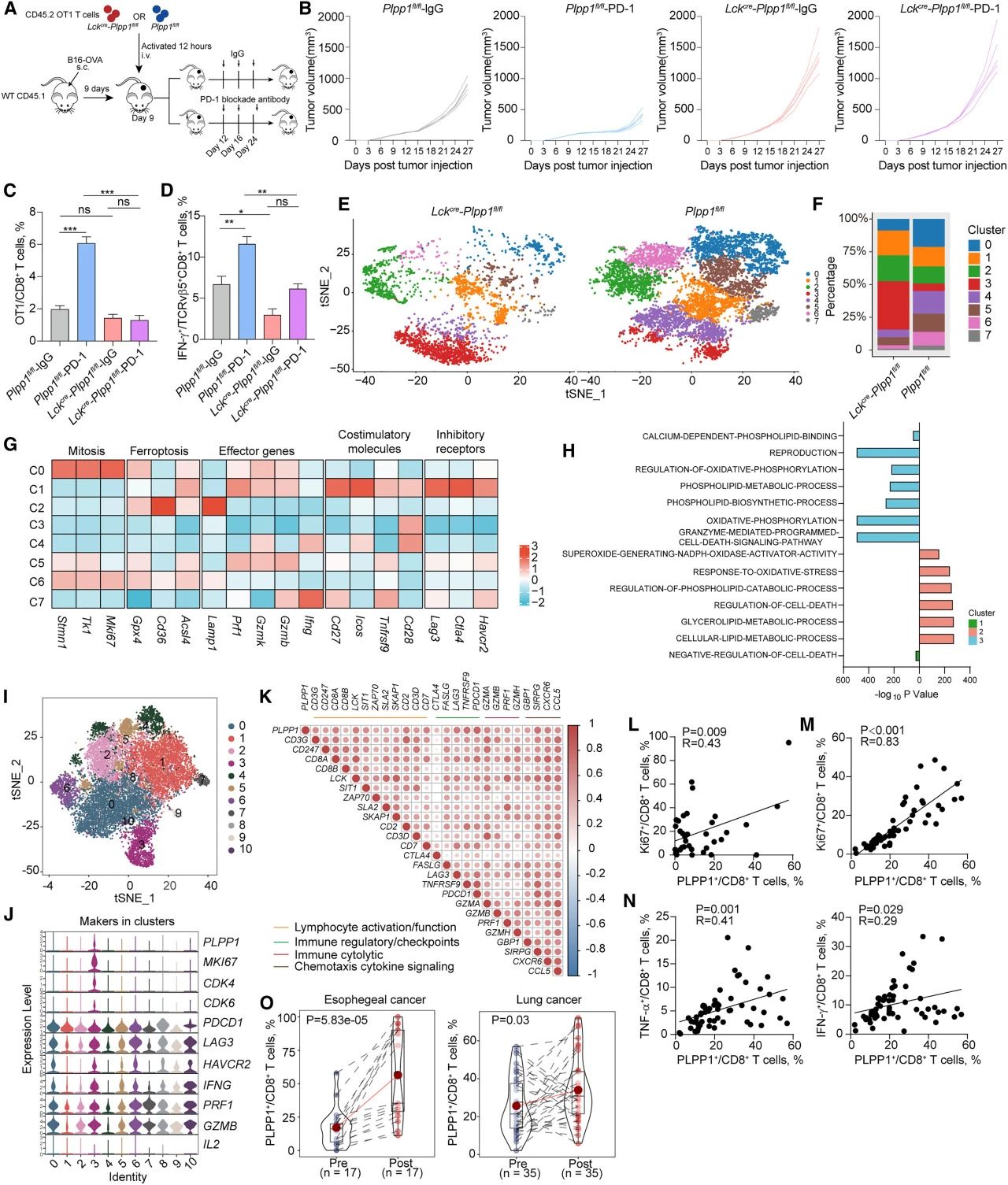
图7.Plpp1缺陷减弱了体内对抗PD-1疗法的反应
研究结论
该研究探讨了肿瘤微环境中CD8+T细胞的磷脂代谢调控机制及其与PD-1信号通路的关联。研究发现,肿瘤内CD8+T细胞的PLPP1表达显著下调,导致PC和PE合成减少,进而诱发铁死亡,削弱CD8+T细胞的抗肿瘤功能。机制上,PD-1信号通过Akt-GATA1通路抑制PLPP1表达,而肿瘤微环境中积聚的不饱和脂肪酸(如花生四烯酸、十八碳烯酸)进一步驱动PLPP1缺陷型CD8+T细胞发生铁死亡。体内实验表明,PLPP1缺陷会削弱抗PD-1治疗的效果,而恢复PLPP1表达可增强CD8+T细胞对免疫治疗的响应。该研究揭示了PD-1信号通过调控磷脂代谢促进CD8+T细胞铁死亡的新机制,为优化肿瘤免疫治疗策略提供了潜在靶点。
END
仲航 撰文
Tang 校稿
