
编者按
未分化甲状腺癌(Anaplastic Thyroid Carcinoma, ATC)是最恶性的内分泌系统肿瘤,中位生存期仅4.8个月,常规治疗手段疗效均极其有限,患者常死于局部肿瘤扩张引起的窒息或肿瘤远处转移。深入研究ATC细胞外基质信号异常活化的调控机制,对通过破坏肿瘤细胞赖以生存的“土壤”达到抗肿瘤作用的治疗目的具有重要意义。
今天,我们特别回顾一项由浙江省人民医院、浙江省内分泌腺体疾病诊治研究重点实验室葛明华教授团队于2022年10月发表在《Molecular Cancer》的研究,通过建立小鼠和斑马鱼肿瘤移植模型,探讨甲状腺未分化癌 (ATC)的生长和转移,表明CREB3L1通过激活细胞外基质(ECM)信号来维持ATC细胞的阳性癌症相关成纤维细胞(CAF)样特性,从而重塑肿瘤基质微环境并促进ATC的生长和转移。
文章题目
CREB3L1 promotes tumor growth andmetastasis of anaplastic thyroid carcinoma byremodeling the tumor microenvironment
杂志:Molecular Cancer(IF=37.3)
发表时间:2022年10月5日
作者:潘宗富,徐通,包黎莎,谭卓,葛明华等
单位:浙江省内分泌腺体疾病诊治研究重点实验室、浙江省人民医院等
01、研究背景
甲状腺癌是最常见的恶性内分泌肿瘤,近年来其发病率逐渐增加。甲状腺未分化癌 (ATC) 是一种罕见但极其恶性的甲状腺癌亚型。根据美国癌症联合委员会(American Joint Committee on Cancer, AJCC)的肿瘤-淋巴结转移(tumor-node-metastasis, TNM)分类系统,ATC患者通常分为IV期,中位生存时间仅为3-7个月。目前,尚无延长患者总生存期的有效疗法。ATC 具有极快的增长速度,并且具有高度侵入性。超过40%的ATC患者有远处转移,常死于局部肿瘤扩大或远处转移引起的窒息。
细胞外基质(ECM)是肿瘤微环境的基本组成部分。ECM的生物学和机械变化深刻影响肿瘤的侵袭、转移、免疫逃逸和耐药性。在原发性肿瘤肿块中,ECM以肿瘤允许的方式严格调节,这反过来又促进了肿瘤进展并影响癌细胞侵袭。通过与基质细胞相互作用,肿瘤细胞重塑ECM,促进共价分子间交联和超分子聚集体(如纤维状胶原蛋白)的大量沉积。几种胶原蛋白亚型与甲状腺癌的发生和发展密切相关。V型胶原在甲状腺癌细胞的粘附、迁移和侵袭中起着重要作用。I型胶原在甲状腺癌中上调,与其患者的生存率低有关。 ATC的一个已知特征是它能够轻松塑造肿瘤基质微环境。与甲状腺状癌(PTC)组织相比,ATC组织中的胶原合成和细胞外基质重塑等生物过程受到过度刺激。鉴于ECM对ATC 的恶性表型具有至关重要的调节作用,迫切需要阐明ATC中ECM重塑的机制。
cAMP响应元件结合蛋白3(CREB3)家族成员位于内质网(ER)膜中,当被S1P和S2P蛋白酶切割时充当转录因子。在哺乳动物中,CREB3家族由五个成员组成,对蛋白质分泌、脂质代谢和生存至关重要。CREB3L1作为促甲状腺激素的调节蛋白,因此,它控制甲状腺组织中胶原蛋白分泌的诱导。CREB3L1异常表达被认为是上皮样纤维肉瘤、乳腺癌和膀胱癌恶性进展的关键驱动因素。在之前的研究中,我们得出结论,CREB3L1是ATC中大多数胶原亚型基因的主要调节因子,这表明它可能调节ECM信号传导。然而,CREB3L1在ATC进展中的确切作用和机制仍然难以捉摸。
在这个研究中,我们发现CREB3L1在间变性甲状腺癌(ATC)的体内、体外,均对肿瘤的发生和转移起到重要作用。它通过KPNA2易位进入细胞核,在那里激活ECM信号传导,并塑造ATC肿瘤基质微环境。这些结果证实,CREB3L1重塑肿瘤间质微环境,并确定CREB3L1是促进ATC的关键驱动因素。
02、研究成果
1. CREB3L1在侵袭性甲状腺癌中高表达,与预后不良相关
为了研究CREB3家族成员在甲状腺癌中的作用,研究者整合并分析了来自四个数据集的 216个样本(78个NT、69个PTC、17个PDTC、52个ATC)。结果显示,ATC组织中只有CREB3L1显著上调。CREB3L1水平随着肿瘤分期的增加而增加,高CREB3L1表达的患者死亡风险更大。
根据单因素分析,CREB3L1表达升高(HR=4.831,95%置信区间[CI]:1.754-13.3,P=0.00231)的甲状腺癌患者比CREB3L1表达降低的患者更容易死亡。此外,总生存期(OS)与T(P=0.00217)、M(P=0.03159)和TNM分期(P=0.0001331)、最大肿瘤直径(P=0.0137)和新辅助治疗史(P=0.0001871)之间的显著相关性。
多因素Cox回归分析表明,TNM分期和高CREB3L1表达均是甲状腺癌患者准确的OS预测因子。在234 例甲状腺癌组织的独立样本中对CREB3L1进行IHC染色显示,CREB3L1的高表达与较短的无进展生存期显著相关(P = 0.000229)。此外,在独立组织样本中,与PTC或NT相比,ATC中的CREB3L1增加,在甲状腺癌细胞系中也观察到类似的趋势。
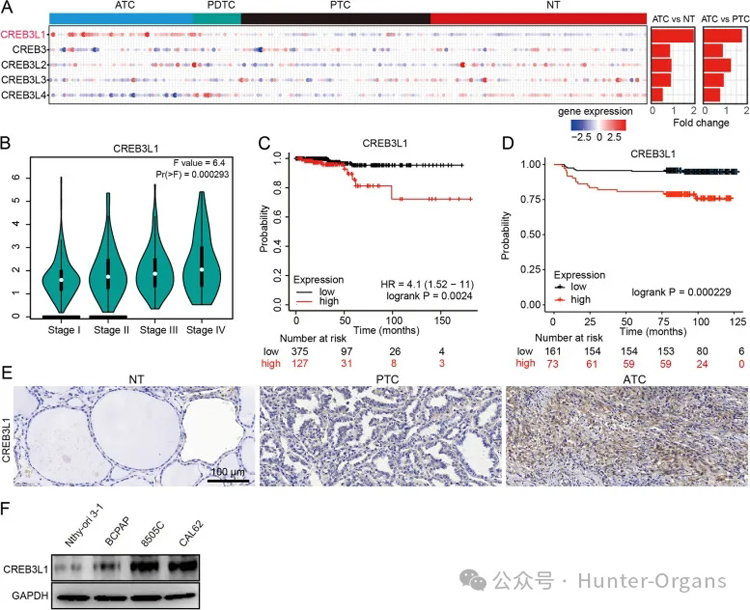
图1. 甲状腺癌中CREB3L1的表达及其临床患病率
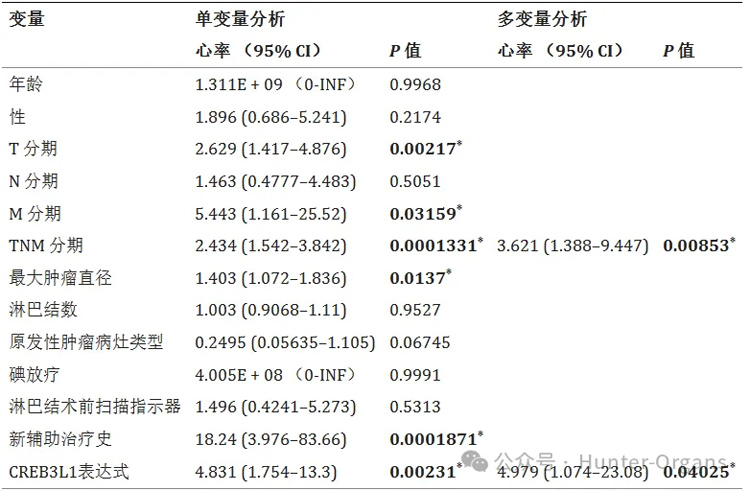
表1. CREB3L1表达与患者预后的单因素和多因素Cox回归分析
2. CREB3L1是ECM中癌细胞侵袭所必需的
鉴于ATC具有快速生长速度和高度侵袭性行为的特点,研究者试图确定CREB3L1的高表达是否是维持ATC侵袭性表型的原因。CREB3L1被敲低或过表达,具有很高的疗效,如蛋白质印迹法所证实的那样。CREB3L1的缺失或过表达对ATC和PTC细胞的增殖和迁移没有明显影响。然而,CREB3L1敲低显著阻碍了ATC细胞的侵袭,而CREB3L1过表达促进了基质胶存在下的PTC细胞侵袭。

图2. 在体外CREB3L1敲除抑制了ATC的入侵
3. 敲除CREB3L1显著抑制了ATC细胞的肿瘤生长和转移
为了可视化CREB3L1对体内ATC转移的影响,采用了斑马鱼异种移植模型。CREB3L1敲除明显降低了ATC细胞来源的异种移植物在5 dpf 斑马鱼上的转移能力。
此外,为了评估CREB3L1表达对体内肿瘤生长的影响,将具有CREB3L1敲低的ATC细胞皮下注射到裸鼠体内。与对照组小鼠相比,携带CREB3L1敲低细胞来源的异种移植物小鼠的肿瘤体积显著降低。
通过静脉注射8505C细胞创建了ATC肺转移小鼠模型。当CREB3L1在模型小鼠中被敲除时,8505C细胞转移强度显著降低。这些数据证实,CREB3L1是一种重要的调节剂,可维持ATC的恶性表型。

图3.CREB3L1敲低可减少体内ATC的转移和肿瘤生长
4. CREB3L1的高表达与ECM信号转导的激活有关
为了描述CREB3L1驱动ATC攻击性的机制,进行了GSEA分析。CREB3L1表达升高与ECM和胶原信号转导的激活显著相关。进一步使用来自四个数据集的216个样本来确定 ECM 和胶原评分。与NT或其他甲状腺癌亚型相比,ATC组织具有显著激活的ECM和胶原信号传导。
更重要的是,CREB3L1的表达与ECM和胶原信号的活性高度相关。免疫荧光染色显示CREB3L1在正常组织和PTC组织中的表达较弱。PTC组织中浸润的成纤维细胞很少,CREB3L1在FAP阳性成纤维细胞中不表达。相反,大量的FAP CREB3L1 CAF浸润在ATC组织中。
此外,许多ATC癌细胞同时表达CREB3L1和成纤维细胞标志物FAP,表明ATC细胞具有CAF样表型。进一步的研究证实,ATC细胞中CREB3L1的敲除显著抑制了各种胶原亚型和合酶的表达,其中COL5A1的下调最为显著。α-SMA的Masson三色染色和免疫组织化学染色证实,CREB3L1的缺失显著减少ATC细胞来源的异种移植物中的胶原纤维和肌成纤维细胞。ATC细胞来源的异种移植物中敲除CREB3L1后COL5A1的含量也明显下降。
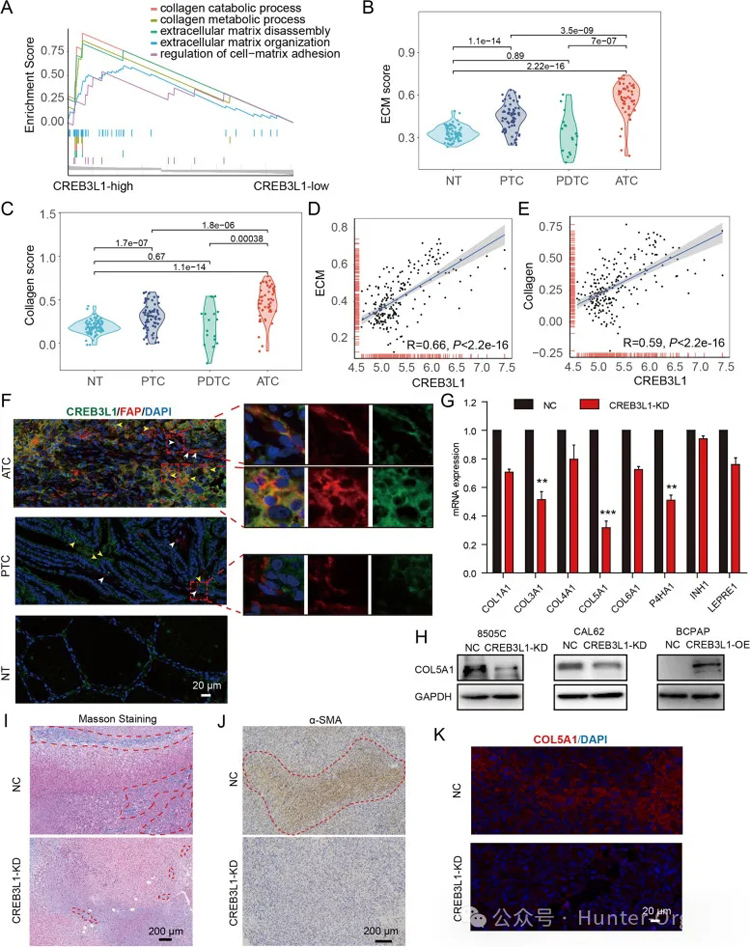
图4. CREB3L1与甲状腺癌的ECM信号转导有关
5. CREB3L1和ECM信号转导的异常表达参与了ATC的演变
为了探究CREB3L1在维持ATC恶性表型中的作用,将两个单细胞RNA测序数据集合并并进行了分析。经过质量控制,共获130,226个细胞16个细胞亚群。CREB3L1在ATC-1和ATC-2亚群以及ATC衍生的成纤维细胞中高表达,但在PTC衍生的成纤维细胞和邻近组织中表达较弱。
对上皮细胞的进一步分析表明,ATC肿瘤细胞中明显存在CREB3L1,其具有极高的ECM和胶原信号转导活性。轨迹分析显示PTC或ATC细胞的不同分支与甲状腺上皮滤泡细胞分化。值得注意的是,在ATC的进化过程中,CREB3L1的表达被显著上调,伴随着ECM和胶原信号转导的活性明显增加。这些结果表明,CREB3L1介导的ECM信号转导对ATC的形成和生长至关重要。
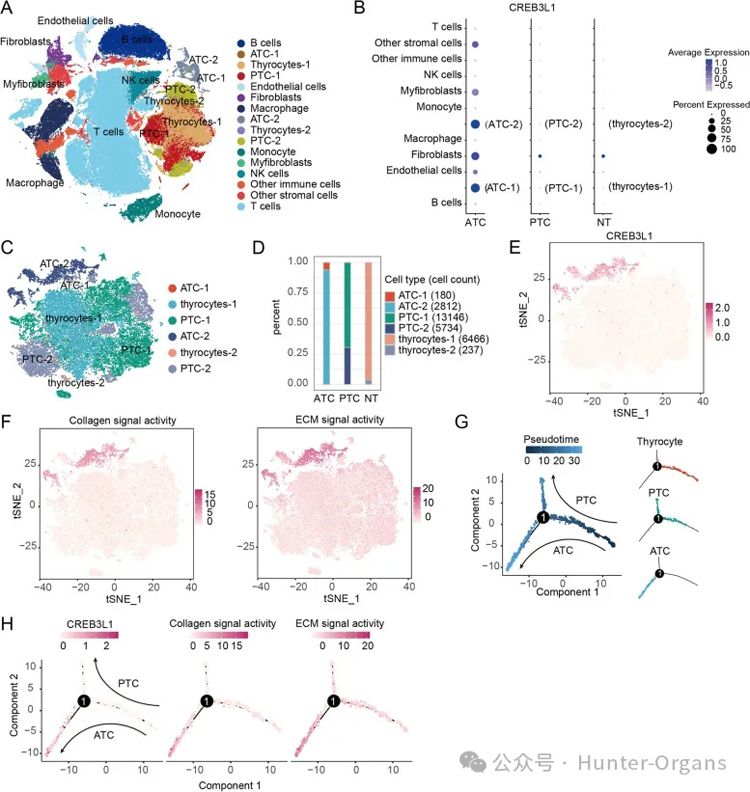
图5. 单细胞RNA测序揭示CREB3L1和下游ECM信号转导在ATC生长中的作用
6. CREB3L1参与诱导α-SMA CAF的分化
癌细胞刺激基质祖细胞分化为CAF,它们的相互作用推动了ECM重塑,创造了一个支持肿瘤生长和转移的癌症生态位。鉴于CREB3L1与ECM信号传导密切相关,研究者研究了CREB3L1是否参与塑造肿瘤基质微环境。
scRNA-seq 分析显示,ATC-1和ATC-2亚群、成纤维细胞和肌成纤维细胞具有频繁的细胞间相互作用。有趣的是,在8505C细胞中敲除CREB3L1并不影响球体的形成,而在CAF存在下,具有CREB3L1敲除的8505C衍生球体明显小于对照组。这表明塑造CAFs需要CREB3L1来支持ATC细胞的生长。
此外,将8505C细胞和CAFs的混合物植入卵黄体外周空间,促进ATC细胞的转移,而敲除8505C细胞中的CREB3L1则显著减少了ATC细胞的转移数量。流式细胞技术分析显示,ATC细胞共培养产生α-SMA CAF,在8505C细胞中敲低CREB3L1后,CAF显著减少。在由8505C和CAFs混合而成的球体中也发现了类似的结果。
我们注意到CREB3L1敲低ATC肺转移小鼠组肺组织中α-SMA CAFs的比例显著降低。大多数ATC转移灶定植在离血管较远的地方,并且经常与α-SMA成纤维细胞共存。相反,CREB3L1敲低减弱了ATC细胞的侵袭能力,其中大多数细胞以及少数α-SMA成纤维细胞定位于血管。
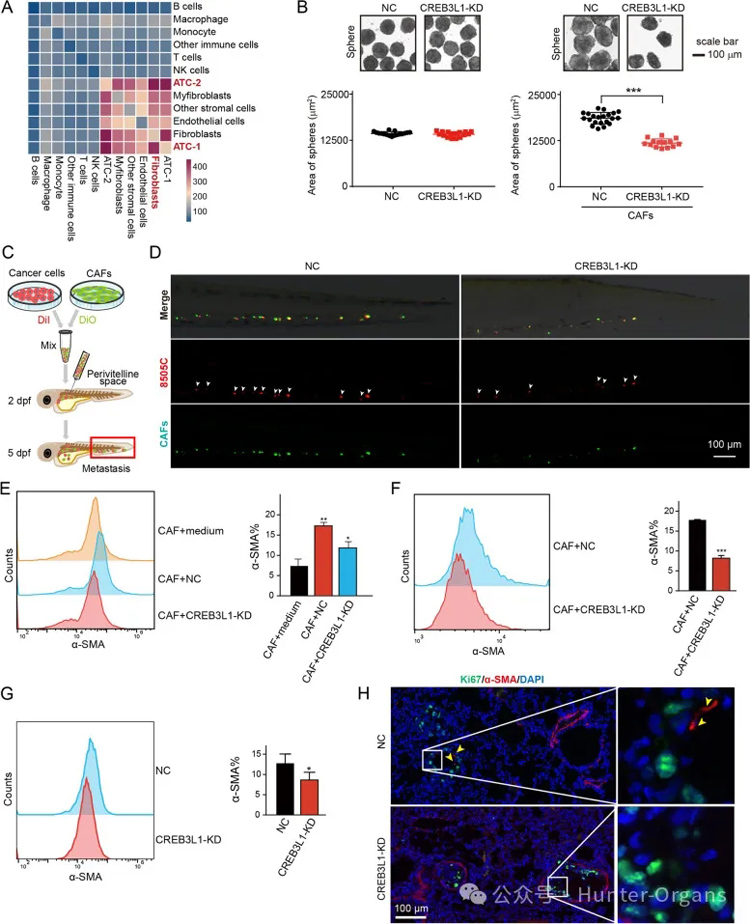
图6.CREB3L1参与重塑ATC的基质微环境
7. CREB3L1促进IL-1α的产生,刺激α-SMACAFs分化
为了探索诱导ATC细胞分化α-SMA CAFs的确切信号,利用细胞因子阵列来分析来自8505C细胞的上清液或敲除CREB3L1后与CAFs共培养物细胞因子的变化。敲低CREB3L1后,8505C上清液中的8种细胞因子和8505C-CAFs共培养上清液中的7种细胞因子在1.2倍的阈值下降低。IL-1α在两个实验中都持续下调,因此被认为是候选细胞因子。ELISA结果证实,当与CAFs共培养时,IL-1α在敲低CREB3L1后下调。外源性IL-1α刺激在8505C细胞中不促进α-SMA CAF分化。
然而,同时敲除8505C细胞中的CREB3L1和IL-1α抑制了 α-SMA CAF 的降低。表明ATC细胞诱导CAF激活的复杂信号。尽管CREB3L1在S1P和S2P切割后被认为是转录因子,但CREB3L1介导的ECM激活机制仍然难以捉摸。核质分离和免疫荧光染色显示ATC细胞中CREB3L1核易位升级。在分析CREB3L1的氨基酸序列时,发现位于氨基酸292和314之间的核定位序列。这表明转运蛋白调节CREB3L1的核进入。因此,研究者筛选了核易位受体超家族的核蛋白成员的表达谱。结果显示,与PTC和NT相比,ATC组织中的KPNA2水平显著升高。
此外,co-IP结果显示,KPNA2(而非importin)与CREB3L1形成复合物,在ATC细胞中的结合水平最高。研究者还发现,KPNA2敲低显著抑制了CREB3L1的核易位,导致其CREB3L1保留在细胞质中。
总的来说,这些结果表明,KPNA2介导的CREB3L1核易位增强了ECM信号,从而驱动了ATC细胞的恶性表型。

图7. KPNA2对CREB3L1的核易位激活IL-1α
03、编者点评
本研究中,CREB家族成员CREB3L1被确定为驱动ATC侵袭性的关键调控因子。基于多组学和多种肿瘤模型的综合分析,研究发现CREB3L1通过激活ECM信号和重塑肿瘤间质微环境,促进ATC肿瘤的生长和转移。
轨迹分析表明,伴随ECM信号的CREB3L1对ATC的进化至关重要。ATC细胞中CREB3L1的表达促进了il-1α介导的CAFs分化,从而重塑了肿瘤生态位。由CREB3L1维持的恶性表型与KPNA2介导的CREB3L1进入细胞核的运输有关,该运输激活了下游的ECM信号。CREB3L1是CREB3转录因子家族的一员,参与重要的生物过程,如代谢、分化和蛋白质分泌。当筛选CREB3家族的表达谱时,研究者发现与PTC和NT组织相比,ATC组织中CREB3L1特异上调,为ATC的发生发展机制以及最终确定潜在的治疗靶点提供了重要的理论支持。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”多维生物技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型,胃癌、脑类器官、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!
